Akut Lenfoblastik Lösemi (ALL), kanımızda ve kemik iliğimizde bulunan beyaz kan hücrelerinin (özellikle lenfosit adı verilen bir alt türünün) kontrolsüz şekilde çoğalmasıyla ortaya çıkan bir kanser türüdür. “Akut” kelimesi, hastalığın genellikle hızlı ilerlediğini, “lenfoblastik” ise olgunlaşmamış (immatür) lenfositlerin bu hastalıkta rol aldığını ifade eder. Burada kastedilen hücreler, henüz tam olgunluğa erişmeden çoğalmaya başlayan küçük askerler gibi düşünülebilir. Normal şartlarda, vücudumuzun bağışıklık sisteminin temel direği olan lenfositler, dışarıdan gelen tehditlere karşı savunma sağlar. Ancak bu hastalıkta, henüz çiçeği burnunda olan bu lenfositler orduya disiplinli bir şekilde katılmak yerine, isyankâr bir tavırla hızla bölünüp yayılarak bütün kemik iliği düzenini bozarlar.
Kemik iliği ise vücudumuzun “kan fabrikası” gibidir. Tüm kan hücrelerimiz — kırmızı kan hücreleri (alyuvarlar), beyaz kan hücreleri (akyuvarlar) ve trombositler — büyük oranda burada üretilir. ALL, bu fabrika ayarlarını karıştırıp işlevsiz bir üretim furyası başlatır. Normal hücre üretimine ket vurulduğu için kansızlık (anemi), enfeksiyonlara yatkınlık ve kanama eğilimi görülebilir. Ayrıca bu kötü huylu genç hücreler, sadece kemik iliğiyle sınırlı kalmayıp karaciğer, dalak ve lenf düğümleri gibi organlara da sıçrayarak büyüyebilirler.
ALL çocukluk çağının en sık görülen kanseridir, ancak yetişkinlerde de görülür. Özellikle çocuklarda tedaviye yanıt genellikle çok daha iyidir. Bu tıpkı genç ve dinamik bir takımın (çocuk vücudu) daha çabuk toparlanabilmesi gibidir. Yine de yetişkinlerdeki vakaların tedavi yöntemleri ve başarı oranları da son yıllarda belirgin şekilde gelişmiştir. Bu tablo tıptaki ilerlemelerin ve kişiye özel tedavi yaklaşımlarının bir yansıması olarak görülebilir.
ALL’i tek bir hastalık gibi algılasak da aslında farklı alt tiplere ayrılır; B hücreli ALL veya T hücreli ALL gibi. Bu alt tipler hastanın tedavi planını ve seyrini etkileyebilir. Örneğin B hücreli tip daha sık görülürken, T hücreli tip bazı farklı tedavi yaklaşımları gerektirebilir. Dolayısıyla ALL, adı tek olsa da “renkleri” farklı birçok senaryoyu barındırır.
ALL’nin Olası Nedenleri Nelerdir?
- Genetik Faktörler
Bazı bireylerde belirli genetik mutasyonların veya kromozomal bozuklukların varlığı, ALL gelişme riskini artırabilir. Örneğin Philadelphia kromozomu adı verilen bir anormallik, ALL hastalarında sık görülen bir genetik değişikliktir ve hastalığın tedavi stratejisini doğrudan etkiler. Bu mutasyonlar, hücrelerin büyümesini kontrol eden mekanizmalarda “şalter” bozulmasına yol açar. Düşünün ki bir bina yönetim sisteminde asansör sürekli yukarı çıkma komutu alsın; işte hücre, sürekli bölünme komutuyla benzer bir karmaşa yaşar.
Bazı çok nadir durumlarda, PAX5, ETV6 veya TP53 gibi genlerdeki kalıtsal (ailesel geçişli) değişiklikler de ALL riskini artırabilir. Ancak bu durumlar genelde toplumun çok küçük bir kısmında görülür. Yani çoğu hastanın ailesinde direkt olarak böyle bir gen aktarım öyküsü bulunmaz.
- Çevresel Faktörler
Çevresel etkenler de lösemi gelişimine katkıda bulunabilir. Yüksek doz radyasyon maruziyeti (nükleer kazalar veya radyoterapi gibi), bazı kimyasallar (örneğin benzene uzun süre maruziyet) lösemi riskini artırabilir. Fakat bu bir kimyasal koklayınca hemen lösemi olunacağı anlamına gelmez. Genellikle, belirgin bir zarar görmek için ya çok yüksek dozlar ya da uzun süreli ve tekrarlayan temas söz konusudur.
- Enfeksiyonlarla İlişki
“Gecikmiş enfeksiyon hipotezi” diye bilinen bir teori, erken çocukluk döneminde bağışıklık sisteminin belli enfeksiyonlarla yeterince karşılaşmamasının, daha ileride aşırı veya düzensiz bağışıklık tepkilerine yol açabileceğini öne sürer. Bu durumda lenfositler, “düşmanla nasıl savaşacaklarını” yanlış öğrenir ve bir nevi kendi vücuduna karşı bir savaş başlatır. Bu teori tam olarak kanıtlanmış olmamakla beraber, ALL gelişimindeki olası mekanizmalardan biri olarak araştırılmaktadır.
Buradaki temel fikir, bağışıklık sistemimizin de eğitim sürecinden geçtiğidir. Eğer bir çocuk, belli enfeksiyonlarla hiç tanışmamışsa, vücut ileride anormal bir tepki verebilir. Tıpkı hiç trafik deneyimi olmayan bir sürücünün, ani bir durumda ne yapacağını bilemeyip paniklemesi ve kaza yapması gibi düşünülebilir.
ALL’nin Belirtileri Nelerdir?
- Yorgunluk ve Halsizlik
En sık görülen şikâyetlerin başında gelir. Bunun temel nedeni, kemik iliğinde normalde üretilmesi gereken alyuvar sayısının azalması (anemi) ve genel olarak vücudun enerji üretim dengesinin bozulmasıdır. Alyuvarlar, oksijeni dokulara taşıyan minik kargo kamyonları gibi görev yapar. Bu kamyonlar azaldığında hücrelerimizin oksijen ihtiyacı tam olarak karşılanamaz. Sonuç? Kendimizi sürekli yorgun ve bitkin hissederiz; merdiven çıkmak bile gözümüzde büyüyebilir.
- Yüksek Ateş ve Sık Enfeksiyon
Beyaz kan hücrelerinin sağlıklı versiyonları enfeksiyonlarla savaşırken, lösemik beyaz hücreler çoğu zaman işlevsizdir. Vücudumuzun polisi var ama devriye gezip suçluları yakalama becerisi yok gibi düşünün. Bu nedenle mikroplarla etkin mücadele yapılamaz; sık sık ateşlenme, tekrarlayan enfeksiyonlar ve uzun süren hastalık periyotları yaşanabilir.
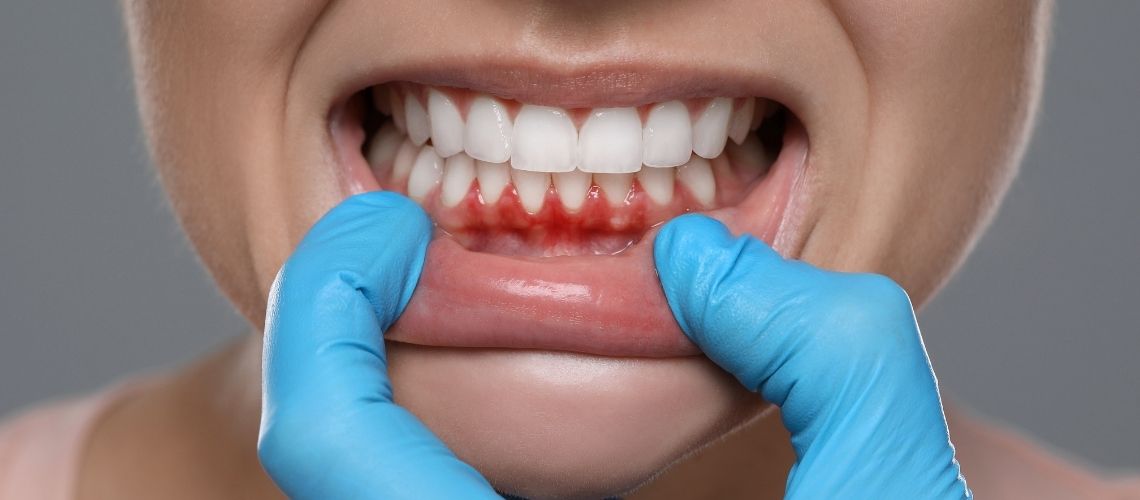
- Kanama ve Kolay Morarma
Lösemik hücrelerin hızla çoğalması, trombosit adı verilen pıhtılaşma hücrelerinin üretimini düşürebilir. Trombositler, vücudumuzdaki küçük “tamirci” hücrelerdir; kanamanın olduğu yerlerde pıhtı oluşturarak kanamayı durdururlar. Sayıları azalınca en ufak darbede bile ciltte morluklar belirir, burun kanamaları artar ve diş eti kanamaları olabilir. Yolda yürürken taşlara takılır gibi, ufak tefek darbeler bile cildimizi kolayca zedeler.
- Kemik ve Eklem Ağrıları
Vücudun kemik iliği “fabrikasında” aşırı miktarda lösemik hücre üretilmesi, kemiklerin iç basıncını arttırarak ağrıya neden olabilir. Özellikle çocuklar, bacak ağrılarından yakınabilir ve yürümede zorlanabilir. Eklem ağrıları da bazen bu tabloya eklenir. Bu durum kemik iliğinin içindeki kontrolsüz hücre yığılmasının dışa vurumu gibidir.
- Lenf Bezlerinde Şişlik
Lenf bezleri, bağışıklık hücrelerinin toplandığı küçük karakollar gibidir. Lösemik hücreler bu karakollara doluşup “kendi kurallarını” işletmeye başladığında, lenf düğümleri gözle görülür bir şekilde şişebilir. En sık boyun, koltuk altı ve kasık bölgelerinde bu şişlikler fark edilir. Genellikle ağrısız olmakla birlikte zamanla büyüyüp rahatsız edici hâle gelebilirler.
- Karaciğer ve Dalakta Büyüme
Karaciğer ve dalak da lösemik hücrelerin uğrak yerlerinden biridir. Bu organlardaki hücre yığılması büyümeye (hepatosplenomegali) yol açar. Karında dolgunluk hissi, iştahsızlık veya çabuk doyma gibi belirtiler gelişebilir. Özellikle dalak büyüdüğünde, karın sol üst tarafında bir rahatsızlık hissi belirebilir.
- Soluk Cilt (Pallor)
Anemi nedeniyle cildin soluk görünmesi de yaygındır. Ten renginiz ne olursa olsun, o eski canlı cilt renginin yerine daha renksiz, cansız bir görüntü ortaya çıkar. Bu değişikliği en kolay tırnak yatakları veya göz kapaklarının iç kısmına bakarak fark edebilirsiniz.
- Nefes Darlığı
Alyuvar sayısı düştüğünde dokulara giden oksijen azalır. Spor yaparken ya da merdiven çıkarken çabucak yorulma, derin nefes alma isteği veya dinlenme ihtiyacı duyma bu nedenle olur. Bu semptom bazen özellikle çocuklarda çok belirgin olabilir; oyun oynarken birdenbire durur, nefes nefese kalırlar.
- Sinir Sistemi Belirtileri
ALL hücreleri beyin ve omurilik sıvısına (meninks) sızdığında, baş ağrısı, baş dönmesi, nöbetler ve bazen de sinir felçleri ortaya çıkabilir. Bu durum her ne kadar yaygın olmasa da omuriliği saran zarlar “kuşatılınca” vücudun nörolojik düzeni etkilenebilir.
ALL Nasıl Teşhis Edilir?
- Kan Testleri ve Periferik Yayma
Kandaki akyuvar, alyuvar ve trombosit sayıları ölçülür. Lösemide sıklıkla anormal derecede yüksek veya düşük beyaz kan hücresi sayısı görülebilir; fakat asıl önemli nokta, mikroskop altında hücrelerin morfolojisidir. Normal bir kan hücresiyle lösemik lenfoblastları kıyasladığınızda, farklı “genç” hücre tipleri, çekirdek görünümleri göze çarpar.
- Kemik İliği İncelemesi
Teşhis için altın standart, kemik iliği biyopsisidir. Bu işlem sırasında kalça kemiğinden bir iğne yardımıyla çok küçük miktarda kemik iliği örneği alınır ve mikroskopla incelenir. Biyopsi, bir çeşit “fabrika denetimi” gibidir; üretim bandında ne tür sorunlar olduğunu, hangi hücrelerin kontrolsüzce çoğaldığını gösterir. Eğer kemik iliğinin en az %20’si lenfoblastlardan oluşuyorsa, ALL tanısı konma olasılığı yüksektir.
- İmmünfenotipleme (Flow Sitometri)
Bu adım, lösemik hücrelerin yüzeyinde hangi proteinlerin bulunduğunu ortaya koyar. Her hücre, üzerinde taşıdığı bazı “kimlik kartları” (yüzey belirteçleri) sayesinde tanınır. Örneğin B hücreli ALL’de CD19, CD10 gibi belirteçler pozitifken, T hücreli ALL’de CD2, CD3 gibi belirteçler öne çıkar. Bu sayede hem hangi alt tipte ALL olduğu anlaşılır hem de spesifik tedavilere yön verilmiş olur.
- Sitogenetik ve Moleküler Testler
Kromozomal analiz (karyotip) veya daha detaylı moleküler testlerle (PCR, FISH gibi) belirli gen bozuklukları saptanabilir. Özellikle Philadelphia kromozomu (Ph+ ALL) gibi durumlar tedavide ek ilaçların (ör. tirozin kinaz inhibitörleri) kullanılmasını gerektirebilir. Bu testler, bir nevi “hücre içi dedektiflik” çalışması gibi düşünülebilir; hangi genler bozuk, hangi genler normal… Bu bilgi, gelecek tedavi planını büyük oranda şekillendirir.
- Beyin Omurilik Sıvısı Analizi
Lösemik hücrelerin merkezi sinir sistemine yayılımı olup olmadığını anlamak için bel (lomber) bölgeden bir iğne ile omurilik sıvısı alınır. Eğer bu sıvıda lösemik hücreler tespit edilirse, ek tedavi yaklaşımları devreye girer. Bu aşama, ALL’de beyni “korumak” adına çok kritik bir değerlendirmedir.
ALL Nasıl Tedavi Edilir?
ALL tedavisi genellikle uzun soluklu ve çok aşamalı bir yolculuktur. Ancak bu yolculukta son yıllarda geliştirilen pek çok yeni yöntem yolun daha güvenli ve daha başarılı geçmesini sağlamaktadır.
Kemoterapi
- ALL’nin temel tedavi taşı, çok aşamalı kemoterapidir. Kemoterapi, hızlı çoğalan hücreleri hedef alan ilaçlardan oluşur. Bu ilaçlar, kanserli hücreleri yok etmeye çalışırken ne yazık ki sağlıklı hücrelere de zarar verebilir. Bu tıpkı bir yangın söndürücünün ortama püskürtüldüğünde hem yanan hem de yanmayan alanları ıslatmasına benzetilebilir.
- Remisyon İndüksiyonu: İlk hedef, kanda ve kemik iliğinde lösemik hücrelerin sayısını ciddi oranda azaltıp “remisyon” denilen duruma ulaşmaktır. Vincristine, kortikosteroidler, antrasiklinler (ör. daunorubisin) ve L-asparaginaz gibi ilaçlar sıklıkla kullanılır. Amaç hastalığı hızlıca köşeye sıkıştırmaktır.
- Konsolidasyon (Yoğunlaştırma): Remisyon elde edildikten sonra, geride kalmış olabilecek mikroskopik düzeydeki kanser hücrelerini yok etmek için daha yüksek doz ya da farklı ilaç kombinasyonları uygulanır. Bu aşama, “temizlik operasyonu” olarak düşünülebilir. Arada gözden kaçabilecek kanser hücrelerini avlamak amaçlanır.
- Bakım (İdame) Tedavisi: Hastalık nüksetmesin (tekrarlamasın) diye daha düşük dozlu ancak uzun süreli tedaviler verilir. Bu dönem, bazen 2-3 yıl sürebilir. Düşünün, evinizi böceklerden temizlediniz, ancak tekrar gelmesinler diye bir süre düzenli ilaçlama yaparsınız. ALL’de de mantık aynıdır. Örneğin metotreksat, 6-merkaptopürin gibi ilaçlar sık kullanılır.
Merkezi Sinir Sistemi (MSS) Koruması
- ALL hücrelerinin beyin-omurilik sıvısına sızma ihtimali nedeniyle, kemoterapiye ek olarak MSS koruması büyük önem taşır. İntratekal kemoterapi (ilacın doğrudan belden omurilik sıvısına verilmesi) sıklıkla kullanılır. Bazen yüksek riskli durumlarda kafaya radyoterapi de eklenebilir. Bu tıpkı kaleye giden gizli bir tüneli kapatma uğraşı gibidir; lösemik hücrelerin sinir sistemine sinsice sızması engellenmeye çalışılır.
Hedefe Yönelik Tedaviler
- Philadelphia kromozomu pozitif (Ph+) ALL gibi belirli genetik alt tiplerde, tirozin kinaz inhibitörleri (TKI) adı verilen özel ilaçlar (ör. imatinib, dasatinib) kemoterapiye eklenir. Bu ilaçlar, kanser hücresinin sürekli aktif kalan ve büyümeyi tetikleyen “motorunu” durdurmaya çalışır. Bu “motora kumanda eden bozuk düğmeyi” devreden çıkarmak gibidir.
Bağışıklık Tedavileri (İmmünoterapi)
- Son yıllarda en heyecan verici gelişmelerden biri, vücudun kendi bağışıklık sistemini kanserle savaşta daha etkin kılmaya yönelik tedavilerdir.
- Monoklonal Antikorlar: Blinatumomab gibi ilaçlar, CD19 gibi belirli yüzey proteinlerine bağlanarak T hücrelerini (savunma hücrelerimizi) kanser hücrelerine doğru yönlendirir. Yani T hücrelerine “Düşman burada, saldır!” diye adres gösterir.
- Antikor-İlaç Konjugatları: İnotuzumab ozogamisin gibi moleküller, bir antikora bağlanmış kemoterapi ilacıdır. Antikor, kanser hücresini bulur; ilaç tam orada serbest kalır. Böylece daha “nokta atışı” bir yaklaşım elde edilir.
- CAR T Hücre Tedavisi: Hastanın T hücreleri laboratuvar ortamında özel bir reseptörle (ör. CD19’u hedefleyen reseptör) donatılır. Bu hücreler, yeniden hastaya verildiğinde lösemik hücrelere karşı adeta “akıllı füze” gibi yönlenir. Bu yöntem özellikle tekrarlayan veya dirençli ALL’de umut verici sonuçlar sunmaktadır.
Kök Hücre Nakli (Allojenik Hematopoetik Kök Hücre Transplantasyonu)
- Özellikle yüksek riskli veya tedaviye dirençli vakalarda, uyumlu bir donörden alınan sağlıklı kök hücreler hastaya nakledilir. Bu tüm “kan fabrikasını” sıfırlayıp baştan kurmaya benzetilebilir. Yüksek doz kemoterapi ve/veya radyoterapi ile hastanın hasarlı kemik iliği temizlenir, ardından sağlıklı kök hücreler yerleştirilir. Tabii bu işlem, ciddi yan etkilere ve risklere sahiptir (enfeksiyon riski, graft-versus-host hastalığı vb.). Bu nedenle ancak belirli durumlarda ve uzman ekiplerce uygulanır.
Kemoterapi ALL’yi Nasıl Tedavi Eder?
Kemoterapinin özü, hızlı bölünen hücrelere “dur” demektir. Lösemik hücreler de hızlı ve kontrolsüz bölünürler. Vincristine gibi bir ilaç, hücre bölünmesi sırasında kritik öneme sahip mikrotübül adı verilen yapılara saldırarak, hücrenin düzgün bölünmesini bozar. Antrasiklinler (ör. doxorubicin, daunorubicin) ise DNA’nın yapısına girer ve gerekli sinyalleri bloke eder. Asparaginaz, lösemik hücrelerin büyümesi için gerekli bir amino asidi parçalar. Hepsi farklı mekanizmalarla kanser hücresini zayıflatıp ölüme sürükler. Ancak bu ilaçlar, normal hücreleri de kısmen etkilediğinden saç dökülmesi, mide bulantısı, bağışıklık sisteminde baskılanma gibi istenmeyen durumlar ortaya çıkabilir.
Kök Hücre Nakli Ne Zaman Gündeme Gelir?
Her ALL hastası için kök hücre nakli gerekmeyebilir. Genellikle şu durumlarda gündeme gelir:
- Yüksek Riskli Genetik Özellikler: Bazı kromozomal bozukluklar hastalığın agresif seyredeceğini gösterir. Eğer hastanın genetik profili çok riskliyse, erken dönemde nakil seçeneği değerlendirilir.
- İlk Tedaviye Yetersiz Yanıt veya Erken Relaps: Bazı hastalarda standart kemoterapiyle remisyon sağlanamaz veya hastalık çok erken tekrarlayabilir. Bu tablo daha yoğun ve kökten bir müdahale gerektirebilir.
- Farklı Tedavilere Rağmen Hastalığın Kontrol Edilememesi: Dirençli vakalarda kök hücre nakli, iyileşme için son derece önemli bir şans sunar.
Burada amaç hastanın lösemik kemik iliğini tamamen ortadan kaldırıp, donörden gelen sağlıklı kök hücrelerle yeniden, sıfırdan bir “kan fabrikası” kurmaktır. Bu süreçte eşlik eden ağır kemoterapi ve bazen radyoterapi, hastanın bağışıklığını geçici olarak yok denecek seviyeye indirir. Yani “eski binaları yıkıp yeniden inşa etmek” gibi bir yaklaşım bu. Sonrasında nakledilen hücreler, yavaş yavaş hastanın kan yapısını normalleştirir.
ALL Tedavilerinin Olası Yan Etkileri Nelerdir?
- Kan Hücrelerinde Düşme ve İlgili Riskler
Kemoterapi, hızlı bölünen tüm hücreleri hedef aldığı için sağlıklı kan hücreleri de zarar görebilir. Bu durum nötropeni (düşük beyaz kan hücresi), anemi (düşük kırmızı kan hücresi) ve trombositopeni (düşük trombosit) gibi problemlere yol açar. Nötropeni, hastayı ciddi enfeksiyonlara açık hale getirir; bu nedenle steril ortamlara dikkat etmek ve enfeksiyon belirtilerini hızla kontrol altına almak önemli olur. Trombositopenide en ufak çarpma bile morarmaya ya da kanamaya sebep olabilir. Anemi ise yorgunluk, halsizlik ve nefes darlığını tetikler.
- Enfeksiyon Riski
Tedavi sırasında hastanın bağışıklık sistemi baskılandığında, çeşitli mikroplar için neredeyse “davetiyesi verilmiş bir parti” ortamı oluşur. Özellikle fırsatçı enfeksiyonlar dediğimiz bakteri, virüs ve mantar türleri, bağışıklık sistemi sağlam bir bireyde zararsızken, bu hastalarda ciddi hastalıklara neden olabilir. Bu yüzden hijyene ekstra dikkat etmek, kalabalık ortamlardan kaçınmak ve sık el yıkamak gibi önlemler çok önemlidir.
- Kalp Toksitesi
Antrasiklin grubu kemoterapi ilaçları (ör. doxorubicin), uzun vadede kalp kası hasarına neden olabilir. Bu nedenle tedavi öncesi ve sırasında düzenli kalp kontrolleri (EKO, EKG vb.) yapılır. Damarları zorlayan bir koşuda, kalbinizin kapasitesini bilmeniz nasıl önemliyse, tedavi sırasında da kalp fonksiyonlarını yakından takip etmek gerekir.
- Sinir Sistemi Üzerine Etkiler
Bazı ilaçlar, özellikle yüksek doz metotreksat gibi, sinir sisteminde (beyin ya da sinirler) yan etkilere sebep olabilir. Bunun sonucu baş ağrısı, konsantrasyon sorunları, hafıza problemleri veya periferik sinir hasarı şeklinde kendini gösterebilir. Ayrıca CAR T hücre tedavilerinde, nörotoksisite veya deliryum gibi durumlar meydana gelebilir.
- Endokrin ve Metabolik Sorunlar
Özellikle uzun süreli kortikosteroid kullanımı obezite, kas güçsüzlüğü ve kemik erimesine (osteoporoz) zemin hazırlayabilir. Bazen büyüme geriliği, tiroit fonksiyon bozukluğu gibi endokrin problemlere de rastlanabilir. Tedavi sırasında ve sonrasında bu konularla ilgili periyodik takipler, çocuklarda büyüme gelişme değerlendirmesi ve yetişkinlerde hormon seviyelerinin ölçümü önemlidir.
- Karaciğer ve Böbrek Hasarı
Bazı ilaçlar (ör. yüksek doz metotreksat, inotuzumab ozogamisin) karaciğer enzimlerinde yükselme veya karaciğer dokusunda hasara yol açabilir. Böbrek fonksiyonları da hedef olabilir; bu nedenle düzenli kan testleri ve gerekirse ek koruyucu önlemler (bol sıvı alımı, belirli ilaçların ayarlanması) uygulanır.
- CAR T Hücre Tedavilerinde Sitokin Salınım Sendromu (CRS)
CAR T hücre tedavisi, bağışıklık sistemini güçlendirse de hızlı bir bağışıklık yanıtı bazen kontrolsüz bir “sitokin fırtınasına” dönüşebilir. Ateş, tansiyon düşüklüğü, solunum sıkıntısı, çoklu organ sorunları gibi ağır tablolara yol açabilir. Uzman merkezlerde uygulanan tedavilerle CRS genellikle kontrol altına alınabilir, ancak bu durumun hayati olabileceği unutulmamalıdır.
ALL’li Hastaların Prognozu Nasıldır?
ALL’nin seyri (prognoz), birçok faktöre bağlıdır. Hastanın yaşı, löseminin alt tipi, kromozomal değişiklikleri ve tedaviye erken yanıtı önemli rol oynar.
Çocuklarda başarı oranları oldukça yüksektir. Bazı merkezlerde 5 yıllık sağkalım oranları %85-90’a kadar çıkabilmektedir. Bu tablo çocuk bağışıklık sisteminin daha esnek ve yenilenmeye müsait olmasıyla ilişkili görülür.
Yetişkinlerde tedavi başarısı çocuklara göre daha düşüktür. Özellikle 40 yaş üstü kişilerde hastalığın seyri nispeten zor olabilir. Buna rağmen son 10-15 yılda tedavilerde büyük ilerlemeler kaydedilmiştir. Yeni ilaçlar, hedefe yönelik tedaviler ve kök hücre nakli imkânlarının genişlemesiyle birlikte yetişkinler için de olumlu sonuçlar alınmaktadır.
Philadelphia Kromozomu Pozitif (Ph+) ALL gibi bazı genetik alt tipler eskiden çok kötü bir seyir gösterirken, tirozin kinaz inhibitörlerinin devreye girmesiyle sağkalım oranları ciddi biçimde yükselmiştir.
Relaps (Nüks) Durumu hala zorlu bir süreçtir. Hastalık tekrarladığında farklı tedavi protokolleri, immünoterapiler veya kök hücre nakli devreye girer. Her relaps aynı değildir; erken relapslar daha yüksek riskli olabilir.
Genel olarak doğru tedavi stratejisi, hastanın durumuna göre bireyselleştirilmiş yaklaşımlar ve destekleyici bakım uygulamaları, ALL’nin üstesinden gelme şansını ciddi oranda artırır.
ALL’li Bir Yakınınıza Nasıl Destek Olabilirsiniz?
Sevdiğiniz birine ALL teşhisi konulduğunda, onların fiziksel ve duygusal ihtiyaçlarını anlamak önemlidir.
- Kanser teşhisi, korku, endişe ve yalnızlık duygularını beraberinde getirebilir. Sakin ve anlayışlı bir şekilde dinlemek, bazen en büyük yardımdır. Söyleyebileceğiniz “Doğru” bir cümleden ziyade, göstereceğiniz samimi ilgi ve sabır daha değerlidir.
- Tedavi süreci uzun ve yorucu olabilir. Hastane randevularına eşlik etmek, ev işlerine yardımcı olmak, ufak alışverişleri üstlenmek veya çocuk bakımına destek olmak çok kıymetlidir. Bazen basit gibi görünen bu yardımlar, hasta yakınlarının üzerindeki yükü hafifletir.
- Hastanızın veya yakınınızın, sağlığıyla ilgili ne kadar bilgiye ihtiyacı olduğunu önceden konuşmak önemlidir. Kimi hastalar çok detay öğrenmek isterken kimileri asgari düzeyde bilgiyi yeterli bulur. İnternetten okuduğunuz her bilgiyi aktarmak yerine, doğru kaynakları (ör. uzman doktorlar, güvenilir tıbbi siteler) referans göstermek daha sağlıklı olabilir.
- Bağışıklık sistemi zayıf olduğu için hijyene dikkat etmek çok önemlidir. Meyve ve sebzelerin iyi yıkandığı, çiğ et veya pastörize edilmemiş gıdalardan kaçınıldığı bir diyet düzeni önerilir. Eğer hastanızda iştahsızlık varsa, sevdiği besinlerin daha cazip sunumlarla hazırlanması faydalı olabilir.
- Bazı günler hastanız kendini halsiz veya sosyal açıdan kapalı hissedebilir. Her zaman enerjik olmasını beklememek, hassasiyet göstermeye çalışmak önemli. Tedaviler sonrası yoğun yorgunluk veya psikolojik tükenmişlik yaşanabilir.
- Bakım verenlerin (aile üyeleri, arkadaşlar) de duygusal yükü çok fazladır. Sürekli endişe, uykusuzluk, hatta suçluluk hissi yaşanabilir. Unutmayın ki siz kendinizi ne kadar iyi hissederseniz, ona o kadar iyi destek olabilirsiniz. Profesyonel psikolojik destek almak veya arkadaş çevrenizden yardım talep etmekten çekinmeyin.

Doç. Dr. Mahmut Bakır Koyuncu, Hacettepe Üniversitesi Tıp Fakültesi (İngilizce Tıp) mezunudur. İç Hastalıkları uzmanlık eğitimini ve ardından Hematoloji yan dal uzmanlığını Mersin Üniversitesi’nde tamamlamıştır. Eğitim sürecinde MD Anderson Cancer Center’da Moleküler Biyoloji ve Genetik alanında çalışmalar yapmış ve Weill Cornell Medicine, New York’ta Kemik İliği Nakli ve Hücresel Tedavi Ünitesi’nde görev almıştır. Türkiye’de Mersin Üniversitesi Hematoloji Bilim Dalı, Mersin Şehir Hastanesi ve Adana Şehir Hastanesi Hematoloji ve Kemik İliği Nakil Ünitesi’nde hematoloji uzmanı olarak çalışmıştır. Temmuz 2023’ten itibaren Mersin’de VM Medical Park Hastanesi’nde hasta kabul etmektedir.